G蛋白偶联受体(GPCRs)是细胞膜受体中最大的家族,在细胞外环境到细胞内信号传导过程中发挥关键作用。它们参与多种生理过程,是最重要的药物靶点之一。GPCR主要通过G蛋白或β-arrestin介导信号传导。经典信号传导过程包括G蛋白激活、GRK介导的GPCR磷酸化以及β-arrestin募集,这一过程在A类和B类GPCR研究中已得到证实,但C类GPCR二聚体对β-arrestin的募集和介导受体内化的机制还不清晰。
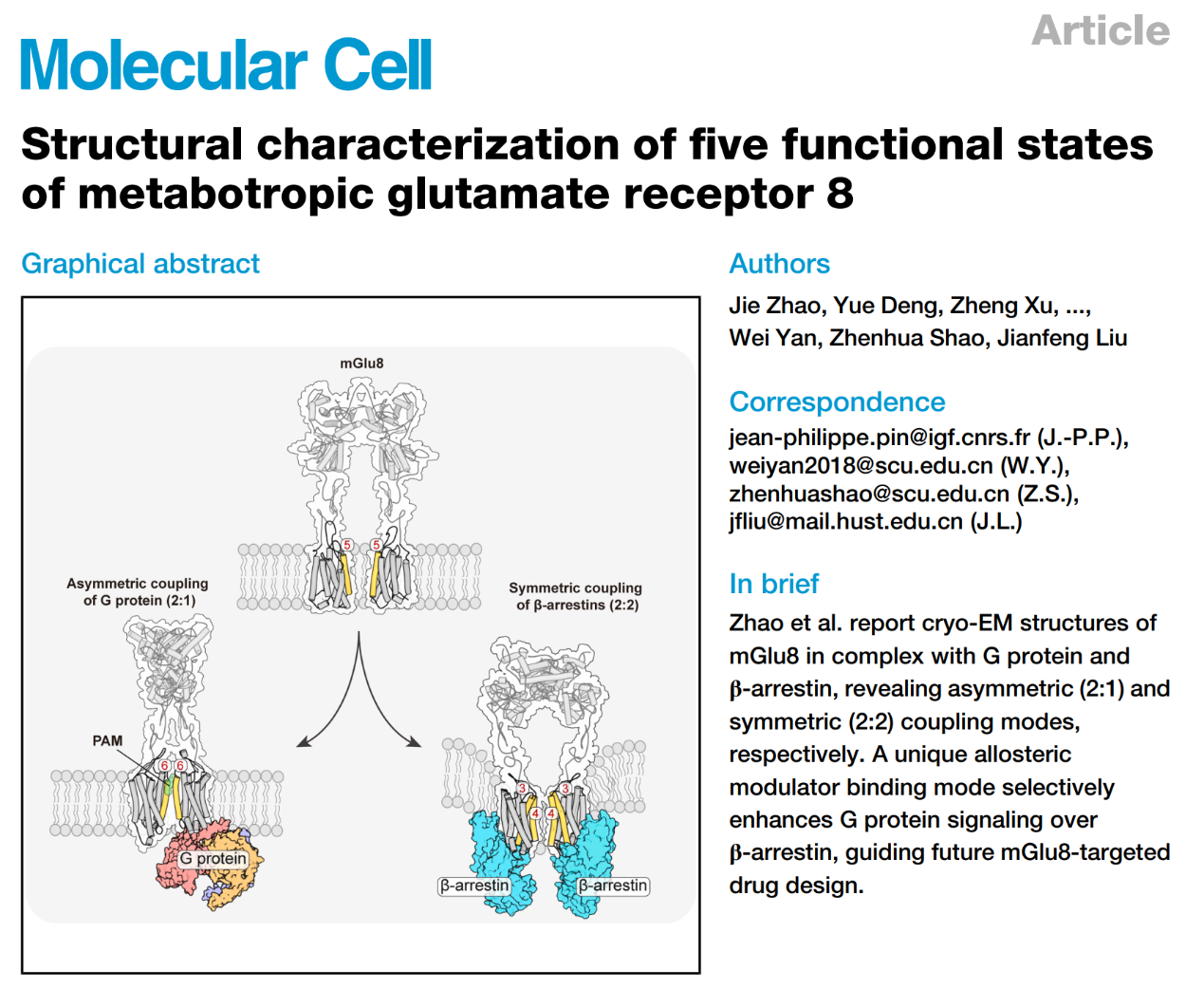
代谢型谷氨酸受体(mGlus)属于C类GPCRs,被兴奋性神经递质谷氨酸激活,在调节突触传递和神经元兴奋性中起关键作用,是阿尔茨海默病、帕金森病、精神分裂症、癫痫和焦虑症等中枢神经系统疾病的重要靶点。mGlu亚基包含胞外捕蝇草结构域(VFT)、七次跨膜结构域(7TM)组成及连接两个结构域的半胱氨酸富集结构域(CRD)。先前研究揭示了mGlu二聚体激活过程中VFT结构域闭合、CRD靠近和7TM结构域重排形成TM6/TM6相互作用界面,并通过一个亚基不对称激活结合G蛋白的激活机制,但mGlu与β-arrestin偶联的功能状态和结构细节仍不明确。在八种mGlu亚型中,mGlu8二聚体是mGluR家族中研究最少的成员。
2025年9月18日,Molecular Cell发表了来自williamhill中国/教育部分子生物重点实验室刘剑峰团队、四川大学华西医院生物治疗全国重点实验室邵振华/颜微团队以及法国功能基因研究所的Pin JP团队的联合研究成果:“Structural characterization of five functional states of metabotropic glutamate receptor 8”。该研究团队通过单颗粒冷冻电镜技术,首次解析了mGlu8二聚体在五种不同功能状态下的高分辨率结构(apo、拮抗剂结合、激动剂+PAM结合、Gi蛋白结合、β-arrestin1结合),系统揭示了其阐明了其选择性偶联G蛋白和β-arrestin1的分子机制,为理解其信号传导选择性和开发偏向性药物提供了重要见解。
研究团队首次发现mGlu8二聚体能够募集β-arrestin,且与以往“一个G蛋白结合一个二聚体”的模式不同,该受体可同时结合两个β-arrestin分子。在mGlu8二聚体与β-arrestin的复合体中,两个VFT结构域均处于闭合状态,但VFT与CRD结构域之间距离较远,7次跨膜区呈现典型的非活性TM3-TM4界面,表明受体整体处于非激活构象;而结合的β-arrestin则呈现典型的激活构象,其C末端发生大幅向上旋转,参与调控mGlu8二聚体的组成性内化过程。此外,研究还揭示正向变构调节剂VU0422288以不对称方式结合于mGlu8二聚体界面的TM6/TM7胞外端,该位点不同于传统mGluR变构调节剂的中心结合口袋,揭示了mGlu8二聚体所特有的偏向性信号转导机制。
该研究系统揭示了mGlu8二聚体受体的激活机制与信号转导过程,发现了一个独特的正构变构调节剂(PAM)结合口袋,并阐明了β-arrestin与C类GPCR结合的分子构象。该机制可通过“双生莲花”形象生动理解:mGlu8二聚体像一对并蒂莲花,其花朵(VFT)与枝条(CRD)的缠绕状态可影响水下(膜内)结构;而当两个独立的β-arrestin分子如游鱼般环绕根部时,则改变莲花姿态,在细胞内激起不同于G蛋白的“信号涟漪”。这一发现为针对mGlu8二聚体受体开发治疗焦虑症、阿尔兹海默症等神经系统疾病的新型靶向药物,提供了关键理论依据与结构基础。

天府锦城实验室(前沿医学中心)副研究员赵杰、四川大学博士生邓悦、四川大学特聘研究员徐政、william威廉中文副研究员许婵娟、四川大学博士后赵畅、四川大学博士生黎紫艳和天府锦城实验室(前沿医学中心)孙辉博士为本论文的共同第一作者。