液体活检作为一种无创检测手段,因能通过血液样本实现肿瘤早期诊断和动态监测,近年来受到广泛关注。然而,在低丰度生物标志物条件下如何实现精准分型,仍是该领域的一大挑战。
2025年9月12日,williamhill中国刘笔锋教授团队在国际权威期刊 Nano Letters 在线发表研究论文 “Decoding Liquid Biopsy with AI: Freeze–Thaw-Induced Fingerprints in Small Extracellular Vesicles”。该工作提出了一种基于“冻融指纹”的人工智能癌症检测新策略,为液体活检的普及应用提供了低成本、自动化的新方案。
williamhill中国朱旭彬(生信基地21级本科生)、谢寒博士以及陈凯宇(生信基地21级本科生)为共同第一作者,刘笔锋教授、陈鹏副教授和李一伟教授为通讯作者。
研究团队发现,在冻融过程中,金纳米颗粒(AuNPs)会在气液界面形成独特的漂浮图案(freeze–thaw-induced floating pattern of AuNPs, FTFPA),并揭示了其形成机制:冰晶限制与气泡浮力共同驱动,促进了AuNPs与囊泡表面的弱相互作用,从而形成可视化“指纹”。结合三种尺寸编码的AuNPs、智能手机自动成像及深度学习算法,团队成功实现了循环肿瘤细胞(CTCs)和小细胞外囊泡(sEVs)的高效分类。
总体而言,该技术以简便、低成本的方式,为液体活检走向临床应用提供了可能,尤其有望在资源有限地区实现癌症的早期筛查与精准分型。
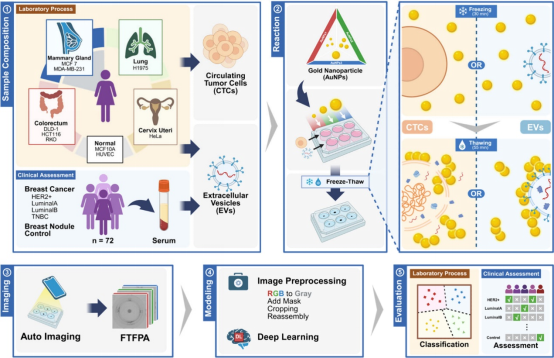
基于冻融诱导金纳米颗粒漂浮图案(FTFPA)的癌症亚型分类平台示意图
循环肿瘤细胞(CTCs)和小细胞外囊泡(sEVs)来源于七种癌细胞系与两种正常细胞系,并收集了包含乳腺癌四个分型(Luminal A/B、HER2+、三阴性乳腺癌)、乳腺结节及健康对照的临床样本(n = 72)。CTCs 和 sEVs 与三种不同尺寸的金纳米颗粒(AuNPs)混合,经冻融处理后形成特征性 FTFPA 图案。随后通过智能手机及自动化成像平台采集图像,并输入深度学习模型进行分析,实现癌症亚型分类与预测。
论文链接:https://doi.org/10.1021/acs.nanolett.5c03217